
背景:
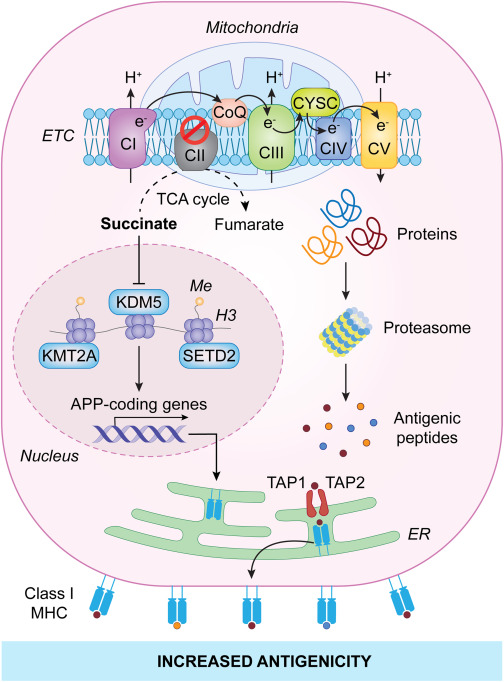
免疫检查点抑制剂 (ICIs) 免疫治疗的临床成功取决于这些药物(重新)激活 CD8+ 细胞毒性 T 淋巴细胞 (CTL) 对抗恶性细胞的能力。然而,CTL 仅在以下情况下才能识别并杀死肿瘤细胞:后者在其表面呈现与 MHC I 类分子复合的抗原。2 ICI 耐药的主要机制之一涉及 MHC I 类分子的丢失或下调,这不仅可以通过遗传和表观遗传事件支持,还可以通过代谢来支持此外,肿瘤突变负荷(TMB)——代表肿瘤中体细胞突变的数量,因此可以(至少部分地)预测肿瘤呈现的抗原数量——与临床对 ICI 敏感性的提高有关。然而,DNA 突变仅占 MHC I 类分子上存在的潜在反应性表位的一小部分,并且越来越多的转录、翻译和翻译后机制被认为是新型抗原决定簇的丰富来源。最近发表在《科学》杂志上的一篇论文表明,改变癌细胞中线粒体电子传递链 (ETC) 的活性会导致三羧酸 (TCA) 中间体琥珀酸的积累。这似乎启动了上调多个基因的表观遗传级联反应 编码抗原加工和呈递 (APP) 机制的组件,包括 MHC I 类分子,因此最终具有优异的肿瘤抗原性以及肿瘤内 TCR 库多样性的增加.
Mangalhara 等人旨在评估影响 ETC 的遗传改变对免疫活性同系小鼠中 BrafV600EPten−/−Cdkn2a−/− 小鼠黑色素瘤 YUMM11.7 细胞生长的影响,并发现细胞缺乏呼吸复合物 II (CII) 的核心成分, 与对照细胞以及缺少呼吸复合物 I (CI) 关键成分(即 NADH:泛醌氧化还原酶亚基 A1 (NDUFA1))的细胞相比,琥珀酸脱氢酶复合物黄素蛋白亚基 A (SDHA) 表现出生长缺陷。这种生长缺陷与恶性细胞上 MHC I 类分子表面水平的大幅增加以及免疫效应细胞(包括活化的 CD8+ T 细胞)对肿瘤浸润的增加有关,这表明 ETC 功能与 APP 之间存在直接联系 机械。事实上,Sdha−/− YUMM11.7 细胞的生长缺陷通过同时删除编码 MHC I 类结合伴侣 β-2-微球蛋白 (B2M) 的基因而完全消除,这是正常 MHC I 类暴露所必需的 在质膜上。此外,在所分析的 36 种人类癌症类型中,有 33 种的公共转录数据集中,CII 编码基因与 T 细胞的遗传特征呈负相关。
在缺乏琥珀酸脱氢酶复合物黄素蛋白亚基 C (SDHC) 的细胞中获得的 CII 遗传抑制以及使用 3-硝基丙酸 (3-NPA) 的药理学 CII 抑制(但不是鱼藤酮的药理学 CI 阻断)也促进 MHC I 类暴露 YUMM11.7 细胞的表面和模型抗原卵清蛋白 (OVA) 的呈递。此外,3-硝基丙酸可促进除 MHC I 类分子以外的多种 APP 因子的上调,特别是参与蛋白酶体衍生肽从胞质溶胶转运至 ER 的两种内质网 (ER) 转运蛋白:转运蛋白 1、ATP -结合盒亚家族B成员(TAP1)和转运蛋白2,ATP结合盒亚家族B成员(TAP2)。有趣的是,虽然 CII 抑制与 YUMM11.7 细胞中干扰素 γ (IFNG) 信号传导增加有关,但删除干扰素 γ 受体 1 (Ifngr1) 或信号转导子和转录激活子 1 (Stat1),这些对于 IFNG 识别和信号转导至关重要 ,无法阻止 CII 抑制下游的 MHC I 类上调。也就是说,转录激活因子 NLR 家族 CARD 结构域包含 5 (NLRC5),也参与 IFNG 信号传导,事实证明与 CII 抑制剂促进 YUMM11.7 细胞抗原呈递的能力有关。
小结:
当癌细胞表面呈现与 MHC I 类分子复合的抗原表位时,细胞毒性 T 淋巴细胞识别并杀死癌细胞。在最近的一篇《科学》论文中,Mangalhara 等人表明,线粒体电子流的改变通过琥珀酸依赖性表观遗传机制上调了参与抗原呈递的多种因素。
论文ID:
原名:Manipulating mitochondrial electron flow enhances tumor immunogenicity
译名:操纵线粒体电子流增强肿瘤免疫原性
期刊: science
影响因子:63.832
发表时间:2023.09.21
发表单位:美国索尔克生物研究所
原文链接:DOI: 10.1126/science.add5787
封面:

内容:
由于已知 CII 可以催化琥珀酸转化为富马酸,并且琥珀酸之前已被证明会影响基因表达,Mangalhara 等人。测试了这种 TCA 中间体在 CII 阻断引起的转录改变中的机制意义。他们发现(1)CII抑制促进琥珀酸积累;(2) 向 CII 感受态细胞施用透膜形式的琥珀酸盐可增加 MHC I 类暴露;(3) 使 YUMM11.7 细胞缺乏谷氨酰胺(琥珀酸盐的主要来源),可有效防止 3-NPA 引起的 MHC I 类分子的积累;(4) 敲除氧化戊二酸脱氢酶 (OGDH),它编码产生琥珀酸前体琥珀酰辅酶 A 的超分子酶亚基,可有效减弱 Sdhc−/− YUMM11.7 细胞中 MHC I 类暴露。因此,CII 抑制似乎通过琥珀酸积累促进 APP。
从机制上讲,细胞内琥珀酸水平升高会降低 α-酮戊二酸/琥珀酸比率,导致各种赖氨酸脱甲基酶受到抑制,同时组蛋白 H3 的几个关键赖氨酸残基的三甲基化增加,这些残基通常与转录调控相关。具体来说,Mangalhara 等人 (1) 涉及 KDM5 家族的 H3K4me3 去甲基酶与 CII 抑制剂促进 MHC I 类暴露的能力有关,以及 (2) 证明对 H3K4me3 具有特异性的组蛋白甲基转移酶,如赖氨酸甲基转移酶 2A (KMT2A) 和 H3K36me3,如 SET 结构域 含有组蛋白赖氨酸甲基转移酶(SETD2),可积极抵消这种作用。对用 3-NPA 或 3-NPA 加 α-酮戊二酸(与琥珀酸竞争)处理的 YUMM1.7 细胞中的 H3K4me3 和 H3K36me3 进行染色质免疫沉淀测序 (ChIPseq),证实了 KMD5 去甲基酶和 NLRC5 对 CII 抑制剂能力的影响 推广APP。
为了规避全身性 CII 抑制不可行的事实,因为多个组织中新发肿瘤、神经毒性、心脏毒性和生物能衰竭的风险增加,Mangalhara 等人工程化 YUMM1.7 细胞缺乏 DnaJ 热休克蛋白家族 (Hsp40) 成员 C15(DNAJC15,最广为人知的名称为 MCJ),C15 是一种 CI 相互作用因子,可促进 CII 超过 CI 和 CIII 活性,但不是最佳 ETC 活性和随后的 ATP 产生所必需的。模仿 Sdhc−/− YUMM11.7 细胞,Dnajc15−/− YUMM11.7 细胞不仅表现出增加的琥珀酸水平和质膜上丰富的 MHC I 类暴露,而且与对照细胞相比,还表现出体内生长缺陷, 这种表型伴随着免疫效应细胞的大量肿瘤浸润,并且可以通过消除 CD8+ CTL 来消除。
总结:
总之,Mangalhara 等人描述了一种将线粒体电子流的改变与琥珀酸依赖性表观遗传途径的启动联系起来的新机制,该途径最终导致多种 APP 因子的上调,从而 (1) 增加肿瘤抗原性和 (2) TCR 库多样化。因此,虽然作者没有正式解决这个问题,但抑制恶性细胞中的呼吸 CII(这在系统上仍然不可行)可能与 ICI 合作(如果不是协同作用)。在 Sdha−/− 或 Sdhc−/− 肿瘤模型中解决这种可能性,或者采用旨在抑制癌细胞中的 CII 的高度针对性的药理学策略,将会很有趣。此外,CII 抑制引起的线粒体功能障碍预计会导致至少某种程度的线粒体透化,这可能与线粒体 DNA (mtDNA) 等免疫原性和干扰性因子的释放有关。因此,评估是否 mtDNA 驱动的 I 型干扰素 (IFN) 合成(已知可促进 MHC I 类表达和抗原呈递)参与 CII 抑制剂促进癌细胞抗原性的能力。最后,虽然已知 MHC I 类分子上抗原呈递的增加可促进 CD8+ CTL 识别和杀死转化细胞的能力,但 MHC I 类分子也是自然杀伤 (NK) 细胞(另一类具有显着抗癌作用的淋巴细胞)的有效抑制剂 至少在某些肿瘤中具有影响。因此,检查 Sdha−/− 或 Sdhc−/− 基因型对通常由 NK 细胞控制的小鼠肿瘤(例如 4T1 三阴性乳腺癌)的影响非常重要。不管这些和其他未知因素,Mangalhara 等人的最新数据为改变线粒体电子流作为使恶性细胞更容易受到 CTL 介导的裂解的策略提供了强有力的原理证明。













